Алкалиновые или литиевые батарейки – какие лучше выбрать?
В этой статье будут рассмотрены особенности алкалиновых и литиевых батареек, а также их преимущества и недостатки. Для педантов сразу отмечу, что под обозначением «батарейки» здесь понимаются первичные источники тока щелочного (alkaline) и литиевого типа. В основном они представлены в продаже цилиндрическими моделями форм-фактора AA (или R6) и AAA (или R3), но на самом деле типоразмеров значительно больше. Можно также назвать C (R14), D (R20). Есть не только цилиндрические, но также дисковые (CR) или призматические («Крона» 9 В). Отличия у них не в форме и размерах, а в типе электрохимической системы, которая и определяет их достоинства и недостатки.
Алкалиновые
Конструкция и состав
Это стандартные батарейки щелочного типа. Алкалиновыми их окрестили за маркировку «Alkaline» (в переводе щелочной) импортного происхождения. Это марганцево─цинковый гальванический элемент питания со щелочным электролитом. В большинстве случаев щелочные батарейки имеют катод из двуокиси марганца (MnO2) с графитосодержащим материалом, а анод из цинковой пасты (Zn). Реже в качестве материала катода применяются оксид серебра (Ag2O) или метагидроксид никеля (NiO(OH)). В качестве электролита применяется гидроксид калия (KOH).
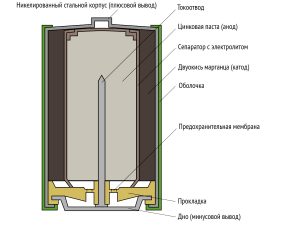
Ниже можно посмотреть конструкцию щелочного источника питания цилиндрического типа.
Во внутренней части цилиндрического элемента находится цинковый порошок, который пропитан щелочным электролитом (анодная масса). Для снятия отрицательного потенциала по центру имеется латунный стержень, который контактирует со стальной тарелкой в нижней части. Ближе к внешней части находится активная масса, представляющая собой смесь диоксида марганца и графита (сажи). От неё положительный потенциал идёт на стальной никелированный стакан. Катод и анод разделяет сепаратор, пропитанный электролитом.
Изоляцию катода обеспечивает оболочка, предотвращающая короткое замыкание. В нижней части можно также увидеть специальную прокладку. Её роль заключается в принятие газов, образующихся в элементе при работе. Если давление превышает допустимый предел, то развивается предохранительная мембрана и батарейка разгерметизируется. В результате из алкалинового источника питания может вытечь электролит.
Реакции
В алкалиновых источниках питания протекают следующие реакции.
На аноде идет реакция с образованием гидроксида цинка и дальнейшим его разложением на оксид цинка и воду.
Zn + 2OH− => Zn(OH)2 + 2e−
Zn(OH)2 → ZnO + H2O
На катоде восстанавливается оксида марганца.
2MnO2 + H2O + 2e− → Mn2O3 + 2OH−
Общий электрохимический процесс в алкалиновой батарейке выглядит следующим образом.
Zn + 2KOH + 2MnO2 + 2e− → 2e− + ZnO + 2KOH + Mn2O3
Конструкция и материалы щелочной батарейки очень близки к солевым источникам питания. Однако в отличие от солевых батареек, в алкалиновых цинк содержится в порошкообразном виде, а не в форме цинкового стакана.
Срок хранения алкалиновых батареек обычно составляет от 3 до 5 лет. Для увеличения этого срока в современные модели производители добавляют ингибиторы коррозии органического происхождения. Существуют малораспространённые алкалиновые элементы с возможностью перезарядки. Они носят название RAM (Rechargeable Alkaline Manganese), что переводится, как перезаряжаемые щелочные марганцевые. Но это не аккумуляторы и количество зарядок у них не более 25.
Вернуться к содержанию
Сферы применения
Ниже перечислены основные сферы применения.
- Фонари.
- Мелкая электроника.
- Переносные магнитофоны.
- Вспышки для фотоаппаратов.
- Радиоуправляемые модели.
- Электронные часы.
Как видите, это устройства, потребляющие относительно высокий ток непродолжительное время, а также те, что требуют небольшое по мощности питание в течение длительного времени. Если подать слишком высокую нагрузку, то может просесть напряжение и потребуется некоторое время на его восстановление.
Вернуться к содержанию
Основные параметры
| Параметр | Значение |
|---|---|
| ЭДС элемента, В | 1.5 |
| Интервал рабочих температур, С | от -30 до +55 |
| Удельная мощность, кВт/куб. м. | от 100 до 150 |
| Удельная энергия, Вт*ч/кг | от 65 до 90 |
Вернуться к содержанию
Литиевые
Конструкция
В случае с литиевыми батарейками есть несколько распространённых типов конструкции. Ниже рассмотрены цилиндрические и дисковые источники тока.
Для цилиндрических моделей применяются бобинная и рулонная конструкция.
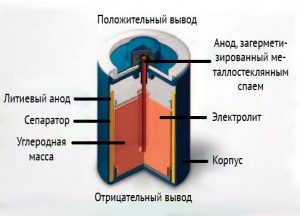
Бобинная конструкция
По центру бобинной конструкции электрод, загерметизированный с помощью металлостеклянного спая. Второй электрод противоположной полярности сделан в виде цилиндра, а между ними находится сепаратор.
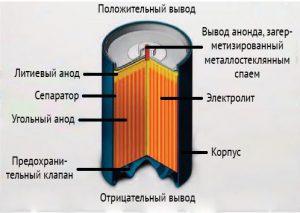
Рулонная конструкция
Рулонная конструкция состоит из лент анода и катода, а также сепаратора между ними. Всё это скручено в рулон и помещено в цилиндрический корпус. В этом случае достигается довольно большая площадь электродов. Благодаря этому увеличивается ток разряда. Кроме того, возрастает саморазряд.
В случае рулонных батареек важно позаботиться о безопасности, поскольку при коротком замыкании (КЗ) ток в них может достигать 20 ампер. Если произойдет КЗ, то из-за сильного разогрева элемент питания может взорваться. Чтобы это предотвратить, конструкции предусматривается плавкий термистор, который еще называют плавким предохранителем. Когда ток превышает определенное значение, термистор разогревается, увеличивается сопротивление материала и ток КЗ снижается.
После устранения короткого замыкания и уменьшения температуры, сопротивление плавкого предохранителя снижается и батарейку можно снова использовать.
Некоторые производители предусматривают дополнительный вид защиты в виде специальной насечки в основании отрицательного вывода элемента. Если давление внутри корпуса превысит определенное значение, то по этой насечке произойдет вскрытие и сброс давления. Так удастся избежать взрыва. После вскрытия литиевая батарейка уже непригодна для использования.
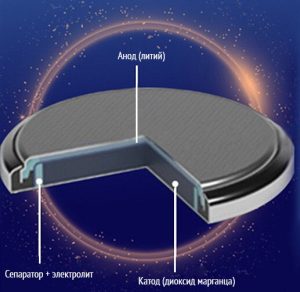
Дисковая конструкция
Дисковые батарейки, как модели бобинной конструкции, обладают меньшей площадью электродов, чем в случае рулона. Однако в них больше взаимодействующих материалов. Благодаря этому они имеют большую доступную ёмкость. Но ток разряда они выдают меньший. Поэтому таблетки и цилиндрические батарейки бобинной конструкции подходят для использования в устройствах с небольшим и средним потреблением тока, которые работают длительное время в автономном режиме. Литиевые элементы питания устанавливаются в тех устройствах, которые недолго работают в автономном режиме, но потребляют высокий ток.
Вернуться к содержанию
Состав и протекающие реакции
Существуют две электрохимические системы, на основе которых создаются литиевые батарейки.
- Литий─диоксидмарганцевые или CR (Li─MnO2).
- Литий─тионилхлоридные или ER (Li─SOCl2).
Вне зависимости от электрохимической системы элемент питания может быть выполнен в вышеперечисленных форм-факторах.
Литий─тионилхлоридные
В этой электрохимической системе катодом является жидкое вещество. В роли анода выступает металлический литий, а катод выполнен из пористой углеродной массы. Электролит представляет собой раствор солей лития (LiGaCl4 или LiAlCl4) в тионилхлориде (SOCl2). Тионилхлорид, помимо функции электролита, выполняет также роль активного материала катода. Химическая реакция, протекающая в этой электрохимической системе, выглядит так.
4Li + 2SOCl2 => 4LiCl↓ + S + SO2
В процессе разряда происходит оседание хлорида лития в порах катода. Когда батарейка близка к полному разряду, начинается оседание серы на катоде. Параллельно происходит растворение оксида серы в электролите.
Вернуться к содержанию
Литий─диоксидмарганцевые
Электрохимические системы на базе MnO2 являются более распространенными при создании первичных источников тока литиевой типа. Здесь роль анода также выполняет металлический литий, активным катодным материалом является термообработанный диоксид марганца ─ MnO2. В системе используются органический электролит, имеющий в своём составе растворенные соли лития LiClO4 или LiCF2SO2. Часто используется диметоксиэтан или пропиленкарбонат. Реакция, происходящая при разряде в этой системе, показана ниже.
xLi + MnIVO2 => LixMnIIIO2
При протекании реакции нет образования каких-то химических элементов, которые бы увеличивали давление в корпусе источника тока. Марганец восстанавливается до трёхвалентного состояния, а также происходит встраивание ионов лития в кристаллическую решётку MnO2.
Система на основе Li─SOCL2 имеет более высокую энергетическую плотность и ёмкость, чем Li─MnO2. Естественно, при одинаковых габаритах и массе. Это обусловлено более высокой активностью тионилхлорида сравнению с диоксидом марганца. Кроме того, номинальное напряжение в первом случае составляет 3,5, а во втором 3 вольта.
Стоит сказать пару слов о таком эффекте, как пассивация у систем Li─SOCl2. Это процесс образования диэлектрической пленки хлорида лития на катоде. Он имеет две стороны медали.
Если после хранения такой батарейки подключить её к устройству, потребляющему большой ток, то произойдет кратковременная просадка напряжения. Впоследствии она выравнивается до нормального значения. Просадка будет тем сильнее, чем дольше на хранении находился источник питания. И тем больший ток будет потребляться нагрузкой. Если же напряжение снизится ниже минимального, то устройство не может просто включиться.
Поэтому после хранения батареек Li─SOCl2 перед подключением к ним нагрузки нужно проводить депассивацию. Причём специалисты советуют учитывать эффект пассивации на стадии проектирования того или иного устройства для его стабильного функционирования. С этой точки зрения процесс пассивации является отрицательным явлением.
В принципе, этот эффект можно преодолеть, если ввести в электролит вещества, способствующие растворению хлорида лития. Но образующаяся пленка имеет и положительный эффект. Он заключается в том, что при хранении предотвращается окисление материала катода. Благодаря этому снижается интенсивность саморазряда. К примеру, у батареек Li─SOCl2,имеющих бобинную конструкцию, составляет всего около 1 процента в год.
Вернуться к содержанию
Сферы применения
- Цифровые фотоаппараты и камеры.
- Автомобильные пульты дистанционного управления.
- Часы.
- Калькуляторы.
- Материнские платы.
- Прочая электроника малого и среднего размера.
Вернуться к содержанию
Безопасность
При использовании литиевых батареек важное значение приобретает вопрос безопасности. Это касается их применения как в промышленных, так и в бытовых устройствах. Нужно позаботиться о том, чтобы параметры эксплуатации не привели к возгоранию, порче оборудования и травмам персонала. Более безопасными считаются источники тока Li─MnO2. В них при хранение и разряде не возникает никаких элементов, увеличивающих давление в корпусе. В электрохимических системах Li─SOCl2 присутствуют подобные элементы, но критического увеличения давления они не вызывают.
Стоит также понимать, что чем больше ёмкость литиевых источников тока (а значит, больше их размеры и масса), тем больше в них активного материала. А значит, серьёзнее будут последствия в случае возгорания. Чем меньше лития использовано в батарейке, тем она безопаснее. Про средства защиты (клапаны, насечки) уже было сказано выше в разделе про рулонную конструкцию.
Характеристики
| Li─MnO2 | Li─SOCl2 | |
|---|---|---|
| Катод | диоксид марганца | тионилхлорид |
| Электролит | перхлорат лития в растворителе (пропиленкарбонат, диметоксиэтан) | тетрахлоралюминат лития в тионилхлориде |
| ЭДС, В | 3.3 | 3.65 |
| Номинальное напряжение, В | 3 | 3.5 |
| Удельная энергия, Вт*ч/кг | 280 | 500-700 |
Вернуться к содержанию
Что лучше – литиевые или алкалиновые?
В итоге, что лучше литиевые или щелочные батарейки? Как и в других подобных случаях, однозначного ответа на вопрос здесь дать нельзя. Выбор нужно делать в зависимости от устройства, где будет работать батарейка. Можно только обозначить преимущества и недостатки обоих типов.
Алкалиновые
Преимущества
- Длительный срок хранения и низкий саморазряд.
- Незначительное падение напряжения по мере разряда.
- Большая ёмкость по сравнению с солевыми источниками тока.
- Показывает хорошую работу при отрицательных температурах.
- Выдерживает значительный ток разряда без просадки напряжения.
- Отсутствие расхода электролита.
- Небольшое газовыделение.
Недостатки
- Низкая энергоёмкость. Отсюда больше размеры и масса.
- Относительно невысокая цена.
Литиевые
Преимущества
- Высокая энергоёмкость. Это значит, что при одинаковых габаритах с алкалиновыми батарейками они имеют большую ёмкость.
- Литиевые источники питания имеют большее напряжение и более высокий разрядный ток.
- Отсутствие газовыделения при разряде или объём выделяющихся газов небольшой.
- Хорошо держат напряжение при высоких нагрузках.
Недостатки
- Содержат в своем составе более токсичные материалы, чем у алкалиновых элементов.
- Требует более аккуратного обращения при эксплуатации. Существует опасность возгорания при коротком замыкании.
- Срок службы дольше, чем у алкалиновых, но и стоят дороже.
Можно однозначно сказать, что выбор в пользу литиевых батареек следует делать тогда, когда требуется обеспечить питание устройств с высоким потреблением тока. Но при этом придется потратиться больше, чем случае со щелочными источниками тока.
Вернуться к содержанию
Опрос
Если статья оказалась для вас полезной, распространите ссылку на неё в социальных сетях. Это поможет развитию сайта. Исправления и дополнения к материалу, а также ваше мнение по поводу различных типов батареек, оставляйте в комментариях ниже. Голосуйте в опросе и оценивайте статью.
Вернуться к содержанию












 (голосов: 10, в среднем: 4,50 из 5)
(голосов: 10, в среднем: 4,50 из 5)









Недостатки: «Относительно невысокая цена» невысокая цена это недостаток??? что за ***** писал статью
Ответа нет какие лучше, статья копипаст.